PROPIEDADES QUÍMICAS DEL AGUA
El agua químicamente pura es un compuesto de fórmula molecular H2O. Un átomo de oxígeno liga a dos átomos de hidrógeno. Los átomos de hidrógeno se "unen" a un lado del átomo de oxígeno, resultando en una molécula de agua, conuna carga eléctrica positiva en un lado y una carga negativa en el otro. Ya que las cargas eléctricas opuestas se atraen, las moléculas de agua tienden a atraerse unas a otras.
Como el átomo de oxígeno tiene sólo 2 electrones no apareados, para explicar la formación de la molécula H2O se considera que de la hibridación de los orbitales atómicos 2s y 2p resulta la formación de 2 orbitales híbridos sp3. El traslape de cada uno de los 2 orbitales atómicos híbridos con el orbital 1s1 de un átomo de hidrógeno se forman dos enlaces covalentes que generan la formación de la molécula H2O, y se orientan los 2 orbitales sp3 hacia los vértices de un tetraedro triangular regular y los otros vértices son ocupados por los pares de electrones no compartidos del oxígeno.
Cuando las moléculas de agua se atraen unas a otras, se unen. Esta es la razón de la formación de las gotas. Si no fuese por la gravedad de la Tierra, una gota de agua tendría forma totalmente esférica.
Las principales propiedades químicas del agua son:
Reacciona con los óxidos ácidos.
Reacciona con los óxidos básicos.
Reacciona con los metales.
Reacciona con los no metales
Se une en las sales formando hidratos
Los anhídridos u óxidos ácidos reaccionan con el agua y forman ácidos oxácidos.
Los óxidos de los metales u óxidos básicos reaccionan con el agua para formar hidróxidos.
Muchos óxidos no se disuelven en el agua, pero los óxidos de los metales activos se combinan con gran facilidad.
Algunos metales descomponen el agua en frío y otros lo hacían a temperatura elevada.
El agua reacciona con los no metales, sobre todo con los halógenos, por ej: Haciendo pasar carbón al rojo sobre el agua se descompone y se forma una mezcla de monóxido de carbono e hidrógeno (gas de agua).
El agua forma combinaciones complejas con algunas sales, denominándose hidratos. En algunos casos los hidratos pierden agua de cristalización cambiando de aspecto, y se dice que son eflorescentes, como le sucede al sulfato cúprico, que cuando está hidratado es de color azul, pero por pérdida de agua se transforma en sulfato cúprico anhidro de color blanco.
Otras características físico-químicas del agua, son:
Acción disolvente. El agua es el líquido que más sustancias disuelve (disolvente universal), esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua. La capacidad disolvente es la responsable de dos funciones importantes para los seres vivos: es el medio en que transcurren las mayorías de las reacciones del metabolismo, y el aporte de nutrientes y la eliminación de desechos se realizan a través de sistemas de transporte acuosos.
Fuerza de cohesión entre sus moléculas. Los puentes de hidrógeno mantienen a las moléculas fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible.
Elevada fuerza de adhesión. De nuevo los puentes de hidrógeno del agua son los responsables, al establecerse entre estos y otras moléculas polares, y es responsable, junto con la cohesión de la capilaridad, al cual se debe, en parte, la ascensión de la sabia bruta desde las raíces hasta las hojas.
Gran calor específico. El agua absorbe grandes cantidades de calor que utiliza en romper los puentes de hidrógeno. Su temperatura desciende más lentamente que la de otros líquidos a medida que va liberando energía al enfriarse. Esta propiedad permite al citoplasma acuoso servir de protección para las moléculas orgánicas en los cambios bruscos de temperatura.

PROPIEDADES QUÍMICAS DEL ACIDO MALEICO
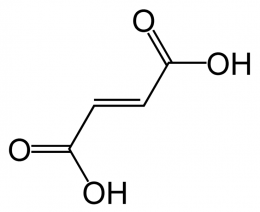
El ácido maleico. Ácido cis-butenodioico o (Z)-ácido butenodioico, es un compuesto orgánico perteneciente al grupo de los ácidos dicarboxílicos. Se conoce con otros nombres como ácido malénico, el ácido maleinico y ácido toxilico. Su fórmula química es C4H4O4.
Propiedades físicas
- EL ácido maleico es el isómero del ácido cis-butenodioico, mientras que el ácido fumárico es el isómero trans.
- Su estado de agregación es sólido en forma de cristales blancos.
- Punto de fusión: 131°C
- Se descompone por debajo del punto de ebullición a 135°C
- Solubilidad en agua: Elevada (44 g/100 ml a 25°C).
- Densidad relativa de vapor (aire = 1): 4
- Densidad relativa (agua = 1): 1.59
- Masa molecular: 116.07 g/mol
Peligros químicos
Combustible
La sustancia se descompone al calentarla intensamente y al arder, produciendo humos altamente irritantes de anhídrido maleico. La disolución en agua es moderadamente ácida. En caso de incendio se despreden humos (o gases) tóxicos e irritantes.
Ingestion
La sustancia se puede absorber por inhalación, a través de la piel y por ingestión.
- Riesgo de inhalación
La evaporación a 20°C es despreciable; sin embargo, se puede alcanzar rápidamente una concentración nociva de partículas en el airecuando se dispersa, especialmente si está en forma de polvo.
- Efectos de exposición de corta duración
La sustancia irrita los ojos, la piel y el tracto respiratorio.
- Efectos de exposición prolongada o repetida
El contacto prolongado o repetido con la piel puede producir dermatitis y puede afectar al riñón.
Aplicaciones
El ácido maleico se emplea en la fabricación de resinas sintéticas y en síntesis orgánicas, actúa como conservante de aceites y grasas y sus sales se utilizan en la tinción de algodón, lana y seda.
Esta resina poliéster insaturada, tiene múltiples aplicaciones, como elaboración de botes, muebles de baño (refuerzos de spas y tina de hidromasaje, lavamanos, tarjas y WC), bases de cocina, sillas, concreto polimérico, losetas, autopartes, tuberías, tanques de almacenamiento. Fabricación de resina alquidal, que es la base de las pinturas alquidálicas que se aplican en pinturas automotrices y arquitectonicas. Elaboración de fertilizantes y agroquímicos, tales como el ácido fumárico. El ácido maleico es una materia prima industrial para la producción de ácido glioxílico por ozonólisis. Es un reactivo que se utiliza mucho en síntesis química de Diels-Alder.
Maleatos
El ion maleato es la forma ionizada del ácido maleico. Es útil en la bioquímica como un inhibidor de las reacciones de las transaminasas. Los ésteres del ácido maleico también se le llaman maleatos, por ejemplo, maleato de dimetilo.
Obtención
En la industria, el ácido maleico se deriva del anhídrido maleico por hidrólisis. El anhídrido maleico se produce a partir de benceno o debutano en un proceso de oxidación. El ácido maleico se convierte en anhídrido maleico por deshidratación, al ácido málico por la hidratación, y el ácido succínico por hidrogenación (etanol/paladio sobre carbono). Reacciona con el cloruro de tionilo o pentacloruro defósforo para dar el cloruro de ácido maleico (que no es posible aislar el cloruro de ácido mono).
https://www.ecured.cu/%C3%81cido_maleico
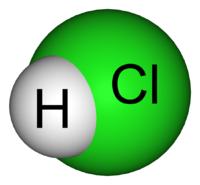
PROPIEDADES QUIMICAS DEL HCL
Es un gas incoloro de olor picante, corrosivo, fumante al aire a consecuencia de su avidez por el agua y formación de un hidrato. Su disolución saturada a 0ºC tiene una concentración de 37% y una densidad es de 1,19 g/cm3. Por el calor y las chispas eléctricas se disocia. Es muy soluble en el agua y al disolverse desprende gran cantidad de calor. El ácido clorhídrico posee las propiedades químicas características de los ácido. Estas propiedades se deben a la presencia de los átomos de hidrógeno en la molécula del ácido.
| Conc. (m/m) c : kg HCl/kg | Conc. (m/v) c : kg HCl/m3 | Densidad ρ : kg/l | Molaridad M | pH | Viscosidad η : mPa·s | Calor específico s : kJ/(kg·K) | Presión de vapor PHCl : Pa | Punto de ebullición b.p. | Punto de fusión m.p. |
| 10% | 104,80 | 1,048 | 2,87 M | -0,5 | 1,16 | 3,47 | 0,527 | 103 °C | -18 °C |
| 20% | 219,60 | 1,098 | 6,02 M | -0,8 | 1,37 | 2,99 | 27,3 | 108 °C | -59 °C |
| 30% | 344,70 | 1,149 | 9,45 M | -1,0 | 1,70 | 2,60 | 1.410 | 90 °C | -52 °C |
| 32% | 370,88 | 1,159 | 10,17 M | -1,0 | 1,80 | 2,55 | 3.130 | 84 °C | -43 °C |
| 34% | 397,46 | 1,169 | 10,90 M | -1,0 | 1,90 | 2,50 | 6.733 | 71 °C | -36 °C |
| 36% | 424,44 | 1,179 | 11,64 M | -1,1 | 1,99 | 2,46 | 14.100 | 61 °C | -30 °C |
| 38% | 451,82 | 1,189 | 12,39 M | -1,1 | 2,10 | 2,43 | 28.000 | 48 °C | -26 °C |
Aplicaciones
- Decapado de metales en industria metalúrgica.
- Neutralizante, reductor e intermediario en síntesis orgánicas e inorgánicas en industria química.
- Solvente de diferentes químicos y materias primas.
- Reactivo para la elaboración de colorantes y tintas.
- Agente blanqueador de grasas y aceites.
- Reactivo para la elaboración de fertilizantes.
- Acidificante y activador de pozos petroleros.
- Agente acidificante, neutralizante y reactivo en procesos de teñido, mercerizado e impresión en la industria textil.
- En la fabricación de productos varios de limpieza.
- Interviene en el proceso de obtención de la cerveza.
- En el proceso de refinación de aceites.
- Utilizado en el tratamiento de aguas industriales y de potabilización de agua.
https://www.ecured.cu/%C3%81cido_clorh%C3%ADdrico
PROPIEDADES QUIMICAS DEL ACIDO FUMARICO
El ácido fumárico posee uno de los mayores poderes como acidulante. Incrementa el poder de gelificantes y se puede mezclar con otros acidulantes. No presenta un sabor picante y extremo. Se usa en gelatinas,refrescos, acondicionadores de masas, mermeladas, conservas, recubrimientos de confites, etc.
Tiene poderes antimicóticos en tratamiento de carnes (mejor que ácido Acético y Láctico). Disminuye hasta el 40% el consumo de Cítrico y el 20% de Tartárico en gelatinas y la cantidad de gel en 2%. Su uso combinado con Benzoatos y ácido Bórico es efectivo contra la degradación de carnes, pescados y mariscos.
Posee excelentes propiedades antioxidantes por lo que ha sido usado enmantequillas, quesos y leche en polvo. Su efecto antimicrobial lo hace útil como aditivo para la preservación de vegetales y frutas.
Propiedades físicas.
Estado de agregación: Sólido
Apariencia: Blanco
Densidad: 1635 kg/m3; 1,635 g/cm3
Masa molar: 116,07 g/mol
Punto de fusión: 287°C
Apariencia: Blanco
Densidad: 1635 kg/m3; 1,635 g/cm3
Masa molar: 116,07 g/mol
Punto de fusión: 287°C
Ácido que regula la acidez
El ácido fumárico tiene una baja acidez; no es muy ácido. En pequeñas cantidades puede utilizarse para regular la acidez de muchos otros ácidos como aquellos que se encuentran en panes y otros productos horneados. Al agregar ácido fumárico a estos alimentos, se ayuda a mantenerlos frescos por más tiempo, además de que se intensifica el sabor del pan. El ácido fumárico también ayuda a repeler el agua debido a su naturaleza básica como un producto alimenticio.
Trabajando con masa
La masa puede ser difícil de trabajar, especialmente con la masa de trigo que se emplea para hacer panes integrales y otros productos saludables. El ácido fumárico, cuando se agrega a cualquier tipo de masa, ayuda a mejorar su maquinabilidad, permitiendo trabajarla más fácilmente de manera que pueda producirse en serie, rápida y eficientemente con la mínima interacción humana.
Propiedades antimicrobianas
El ácido fumárico también es un excelente antimicrobiano -- puede acabar con microbios y otros microorganismos que de lo contrario podrían desarrollarse en la masa u otro entorno alimenticio. Esto significa que puede utilizarse para prolongar la vida de anaquel de forma segura como parte de un programa de tratamiento para la conservación de alimentos.
Repelente al agua
El ácido fumárico no es higroscópico -- no absorbe agua del ambiente, como la humedad del aire. Esto significa que también es un excelente medio para evitar que alimentos como el pan, absorban agua del aire, lo que podría ocasionar que las esporas de moho u otros microorganismos crezcan en la comida.
Usos
Se ha empleado en dietas de cerdos con éxito en el incremento de peso, mejora de la actividad digestiva y disminución de bacteriaspatógenas en el sistema digestivo.
https://www.ecured.cu/%C3%81cido_fum%C3%A1rico

visit wholesale sex toys,dildos,dildo,sex chair,vibrators,wolf dildo,cheap sex toys,sex toys,realistic dildo Full Article
ResponderEliminar